miércoles, 28 de diciembre de 2022
miércoles, 14 de diciembre de 2022
lunes, 28 de noviembre de 2022
¿QUÉ ES EL CPAC? | CPAC, SIGNIFICA: MOVIMIENTO CONSERVADOR INTERNACIONAL
ES LA NUEVA DERECHA DE LAJE
viernes, 18 de noviembre de 2022
martes, 26 de julio de 2022
PRIONES 20210610
Identificados dos aminoácidos que favorecen la resistencia a las infecciones con priones
Las Encefalopatías Espongiformes Transmisibles (EETs) son enfermedades neurodegenerativas fatales causadas por la conversión de la proteína del prion fisiológica (PrPC) en la isoforma patógena y mal plegada (PrPSc). Las EETs incluyen diferentes enfermedades como la Encefalopatía Espongiforme Bovina (enfermedad de las vacas locas), el scrapie en ovejas y cabras, la caquexia crónica del ciervo y la enfermedad de Creutzfeldt-Jakob en humanos. La interacción de la isoforma patógena malplegada (PrPSc) con la fisiológica (PrPC) se considera el evento clave en la transmisión de los priones. Se ha demostrado que las diferencias en la secuencia de aminoácidos entre la PrPC del animal receptor y la PrPSc del animal donante de la infección constituyen el determinante principal de la barrera de transmisión de las cepas de priones. Por ello, los ratones transgénicos que expresan la PrP de una especie en particular, en ausencia de la PrP endógena del ratón, se consideran modelos ideales para caracterizar el resultado de la transmisión de cepas de priones entre diferentes especies.
La secuencia de la PrP de diferentes especies de mamíferos presenta grandes similitudes. Al comparar la secuencia de la PrP humana con la de otras especies susceptibles a la infección con priones, como las ovejas, ciervos, vacas y macacos, se observa que la PrP humana posee unos cambios en los residuos de aminoácidos de la PrP en las posiciones 166 y 168 frente a los presentes en otras especies.
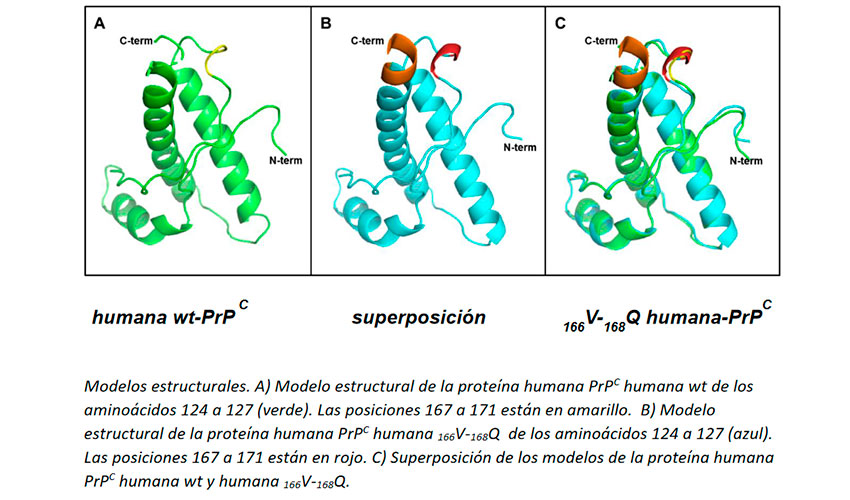
Por todo ello, un estudio del grupo de Biología Molecular y Celular de Priones del Centro de Investigación en Sanidad Animal del INIA-CSIC ha comparado la capacidad de transmisión de una amplia colección de cepas de priones de diferentes especies en dos líneas de ratones transgénicos que expresan niveles similares de la proteína PrP humana o de la PrP humana con valina y glutamina en las posiciones 166 y 168 de la PrP. De este modo, estos ratones sólo se diferencian por ambos cambios de aminoácidos y las alteraciones frente a la infección con priones sólo se deben a dichos cambios.
Los resultados obtenidos han demostrado que los residuos de metionina
y glutámico en las posiciones 166 y 168 de la PrP son responsables de
impedir o reducir notablemente la propagación de la mayor parte de las
cepas de priones ensayadas. Esto sugiere que estos cambios de
aminoácidos han sido seleccionados evolutivamente en la especie humana
para limitar la susceptibilidad frente a diferentes cepas de priones,
tanto animales como humanos. Por ejemplo, si la especie humana no
hubiese tenido los cambios a metionina y glutámico en las posiciones 166
y 168 de la PrP, la ingestión de productos ganaderos contaminados con
priones de la enfermedad de las vacas locas o del scrapie ovino podría
afectar mucho más agresivamente a la especie humana.
https://www.interempresas.net/Ganadero/Articulos/353541-Identificados-dos-aminoacidos-que-favorecen-la-resistencia-a-las-infecciones-con-priones.html
PRIONES 20220726
Químico Simple Detiene La Enfermedad Priónica
Las vacas locas, la tembladera y la enfermedad de Creutzfeld-Jakob son todas las enfermedades del cerebro que debilitan antes de matar, y no tienen cura, o incluso muchas opciones de buen tratamiento más allá de la atención de apoyo. Pero ahora, los investigadores en Suiza dicen que es posible bloquear las proteínas mal plegadas llamadas priones que causan estas enfermedades, mediante el uso de un compuesto que los biólogos han usado para rastrear otras moléculas.
Los priones son un tipo distinto de proteína: pueden auto replicarse, dijo Adriano Aguzzi, profesor de neuropatología en la Universidad de Zurich, quien dirigió el estudio. Cuando un prión entra en contacto con una proteína normal, hace que la proteína normal altere su forma y también se convierta en un prión. Las vacas locas y la tembladera afectan a las vacas y las ovejas, respectivamente, y la enfermedad de Creutzfeld-Jakob (ECJ) afecta a las personas.
En el nuevo estudio, el equipo de Aguzzi utilizó productos químicos llamados politiofenos conjugados luminiscentes, que son compuestos fluorescentes que los investigadores a menudo usan para teñir muestras de tejidos, para que puedan ver lo que sucede en las células. El equipo primero infectó ratones con una enfermedad priónica y luego les inyectó politiofenos.
Encontraron que algunos politiofenos aumentaron la supervivencia de los ratones en más del 80 por ciento, en comparación con los ratones de control que no fueron inyectados con politiofenos.
Esto significó que algunos ratones sobrevivieron hasta 140 días después de la infección si obtuvieron el politiofeno antes de infectarse con priones, y hasta 100 días si fueron tratados una vez infectados. "Me sorprendió bastante que funcionara tan bien", dijo Aguzzi.
Los priones infecciosos ingresan al cerebro después de que las personas o los animales comen alimentos que están contaminados con ellos. Finalmente, las proteínas se replican hasta el punto en que forman placas que pueden matar las células cerebrales y le dan al cerebro la apariencia "esponjosa" que es característica de las enfermedades priónicas (las enfermedades se denominan formalmente encefalopatías espongiformes transmisibles). [10 cosas que no sabías sobre el cerebro]
Aguzzi explica cómo exactamente cómo los priones matan a las células aún está bajo debate, pero no hay duda de que las proteínas se replican rápidamente una vez que comienzan a unirse con ciertas proteínas en las células del cerebro, y solo se necesitan unos pocos priones para iniciar el proceso.
Los priones también son muy difíciles de eliminar. Las moléculas están estrechamente ligadas, incluso las temperaturas del agua hirviendo no las romperán.
En el estudio, Aguzzi dijo que el equipo realizó extensas simulaciones por computadora de cómo interactúan las moléculas antes de inyectarlas en los animales, para aprender las "reglas" de cómo los químicos interactúan con los priones.
El trabajo se basa en experimentos realizados por Beat Meier, investigador del Instituto Federal de Tecnología de Suiza, dijo Aguzzi. Meier utilizó imágenes moleculares para descubrir la estructura o los priones infecciosos en 2008. "Nadie había visto antes la unión, porque nadie conocía la estructura de un prión antes".
Otro paso fue un proyecto que estudia un problema completamente diferente. Peter Nilsson, un biólogo químico de la Universidad de Linköping en Suecia, estaba experimentando con plásticos conductores, pero encontró un químico que pensó que podría unirse a los priones.
Las simulaciones por computadora mostraron que los politiofenos podrían encajar en un espacio que se encuentra en un extremo de un prión y bloquearlo para que no se conecte con las proteínas normales.
Queda por verse si los politiofenos podrían administrarse de manera segura a las personas: aún no se conoce su toxicidad, e incluso más lejos están las pruebas que estudian si pueden ser efectivas para ayudar a las personas con CJD.
"Las sustancias descritas en un nuevo estudio no son necesariamente las que entrarán en los humanos", anotó Aguzzi. Sin embargo, los nuevos hallazgos muestran que existe un camino para producir moléculas que podrían detener las enfermedades que causan los priones.
El estudio aparece en la edición de hoy (5 de agosto) de Science Translational Medicine.
https://es.wordssidekick.com/simple-chemical-stops-prion-disease-9654
Una molécula utilizada para rastrear proteínas podría ayudar a detener enfermedades como mad cow y creutzfeld-jakob.